
金属键强弱的影响因素(微粒半径大小比较方法)
研究高考题多了,你就会发现高考的题目虽年年换着新装但是其内在的姑娘却依然是以前的那个你熟悉的伊人。
从而要想在高考中获得高分,不在于研究高考题目的变化而在于掌握哪些永恒不变的知识点的本身,掌握好了知识点不管其外衣如何花枝招展最后我们都能准确的得到准确的答案。
今天我们就来解析高考中微粒半径大小比较的题目,抓住其核心要点总结规律以准确拿全这一知识点的分。如果时间紧急可直接拉到第三点答题规律部分。
一、考点考察方式
微粒半径大小关系的比较常常出现在高考化学中常常于选择题的物质推断题和选三中出现,直接的考察一般都是一个选项,分值在两分左右。
微粒半径大小关系的比较虽然直接考察的分值比较少,但是微粒半径大小的比较是学生必须掌握的知识点,这主要的原因在于微粒的半径是共价键键能大小、离子键键能大小、金属键键能大小的重要决定因素,而共价键键能、离子键键能、金属键键能的大小直接决定原子晶体、离子晶体、金属晶体熔点高低,而晶体熔点大小的比较是高考的必考考题,从而确定了考点离子半径大小关系的重要性。我们先以高考真题的形式来看看高考对该考点的考察形式。
1、[2019新课标Ⅱ] 近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(3)比较离子半径:F−__________O2−(填“大于”等于”或“小于”)。
2、[2018新课标Ⅰ卷] Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(2)Li+与H−具有相同的电子构型,r(Li+)小于r(H−),原因是______。
3、(2018·课标全国Ⅲ,13)W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含YZW的溶液。下列说法正确的是( )
A.原子半径大小为W<X<Y<Z
4、(2017·课标全国Ⅱ,9)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是( )
A.原子半径:d>c>b>a
5、(2017·课标全国Ⅲ,12)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
D.简单离子的半径:Y<X
二、做题常见错误点及其考点出处
在做微粒半径大小关系比较的题目时,学生常常在以下几个方面出错。
第一方面在于不能根据题目的信息推断出所给的元素;第二方面在于不知道从哪些方面去进行离子半径的大小比较;第三个方面在于不能灵活运用原子半径变化的规律。第四个方面在于语言凝练不够,答题没有答到要点。
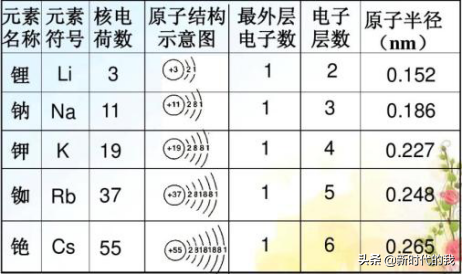
微粒半径的第一次系统的出现在于人教版必修二的第一章第一节,此处主要是根据给出的碱金属元素的原子半径的递变性而推断得出同一主族元素金属性的变化规律。
微粒半径的第二次系统的出现在于人教版选修三的第一章第二节,此处主要是涉及到元素周期律的总结。
三、答题规律总结
要准确比较微粒半径的大小关系,万能的判断方法在于根据微粒的结构示意图来进行。注意此处的微粒指的是微粒,其可以是原子也可以是简单的阴阳离子,此处总结的是高考答题时用到变化规律,对于一些具体物质而言可能出现例外;在比较微粒半径大小时,不比较稀有气体原子。
根据微粒结构示意图判断半径大小关系的解题步骤:
一看电子层数。第一步看的是微粒核外电子层数的多少,电子层数越多则微粒的半径越大,如r(K)>r(Na)。
二看核电荷数。在微粒的电子层数相同时,比较微粒核电荷数的大小,核电荷数越大,微粒的半径越小,如r(K)>r(Ca)。
三看核外电子数。在电子层数和核电荷数都相同的时候,此时看核外电子数的多少,核外电子数越多,微粒的半径越大,如r(Fe2+)>r(Fe3+)。
为了快速而准确的答题,有两个微粒半径大小的变化规律是必须掌握的。
规律一:同一周期,从左到右原子半径逐渐减小;同一主族,从上到下原子或同价态离子的半径逐渐增大。
规律二:同一种元素,阳离子半径小于对应的原子半径,阴离子半径大于对应的原子半径,如 r(Na)>r(Na+),r(S2—)>r(S)。
考试的高分秘籍并不是考的题全会而在于答的题全对,一个个知识点掌握到位最后我们必将答的全对。
- 上一篇:高一生物必修一知识点总结(生物必修一重点考点归纳)
- 下一篇:没有了



 微信收款码
微信收款码 支付宝收款码
支付宝收款码