
硝酸铵化学方程式(高中化学课外知识点补充)
黎巴嫩爆炸事故发生后,小编们第一时间对事故“元凶”进行了报道分析。
文章发出后,后台收到不少读者留言,希望对硝酸铵进行更细致的安全知识介绍,以加强防范。
今天,特别邀请化工行业资深安全专家雷平妹老师给大家带来更为专业、更深刻的解读。
黎巴嫩大爆炸、2015年天津港爆炸、2019年3月21日的响水大爆炸的背后,都有着硝基类物质的身影。本文将从的化学性质、爆炸机理、热稳定性发现等方面,揭开硝酸铵的面纱。
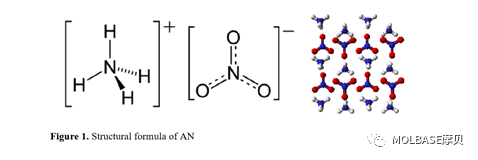
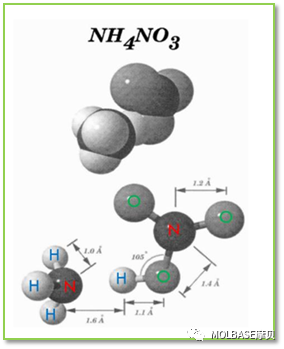
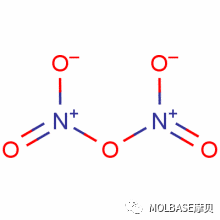
1、硝酸铵(Ammonium Nitrate )的化学结构
20 °C 时硝酸铵的分子量是 80.052 g/mol,密度是 1.725 g/cm3
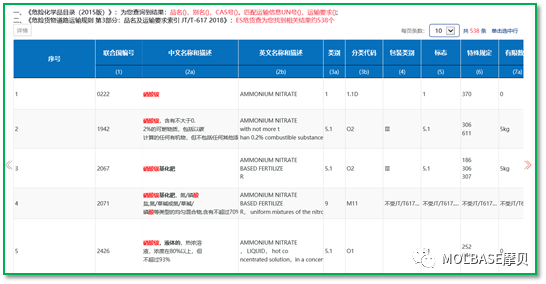
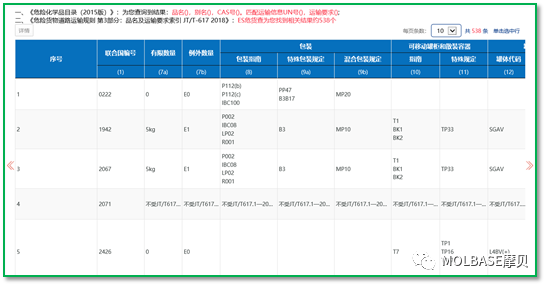
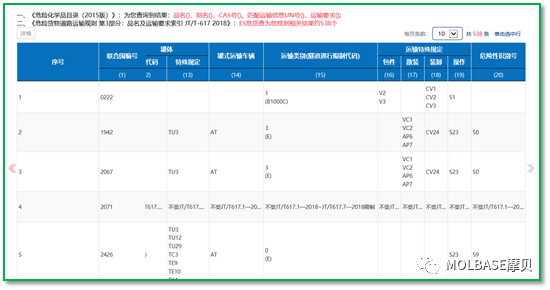
2、硝酸铵的分类
按照ADR2019或JT617-2018,硝酸铵按照其浓度可以分类成1类爆炸品、5.1类氧化剂或9类其他危险货物。在做硝酸铵的分类测试时,按照UN测试分类方法,进行科学分类,如下表解释了不同浓度硝酸铵分类的结果,浓度的高低依次决定了是1类、5.1类还是9类危险货物。
3、硝酸铵的热稳定性影响因素
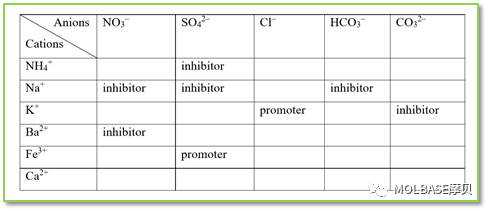
硝酸铵是工业上广泛使用的肥料之一,也是氮肥最集中的形式。但是,硝酸铵经常与过去连续发生的火灾、爆炸等危险相关联。硝酸铵在环境温度和压力下不是易燃或可燃材料,但它是一种强氧化剂,在一定条件下会发生爆炸;硝酸铵的热稳定性与爆炸有关,影响其热稳定性的主要有添加剂、受限空间、加热速率、温度、发热历史、样品大小、反应热力学、反应动力学以及水作为一种化学物质的作用;热稳定性研究发现,硝酸铵在约200°C的温度下稳定。硫酸钠是一种很好的硝酸铵分解抑制剂,因为它的存在可以减轻硝酸还原分解,而氯化钾是一种促进剂,因为它能增强逃逸反应(失控反应)。硝酸铵即使混合了抑制剂,也必须与促进剂分开储存。
表一、硝酸铵不同添加剂的矩阵表(Inhibitor-抑制剂;Promoter-促进剂)
水在物理和化学上干扰可能导致相关火灾场景;选择水处理相关火灾时,应谨慎行事。有证据表明,水量不足可能加剧火灾后果,因为少量水被高温汽化,反而加剧燃烧,所以一定要事先计算消防用水量,确保足够的水量来灭火此外,避免硝酸铵储存在热的或密闭空间中,并限制硝酸铵堆垛的大小,防止蓄热和积热引发自燃爆炸。
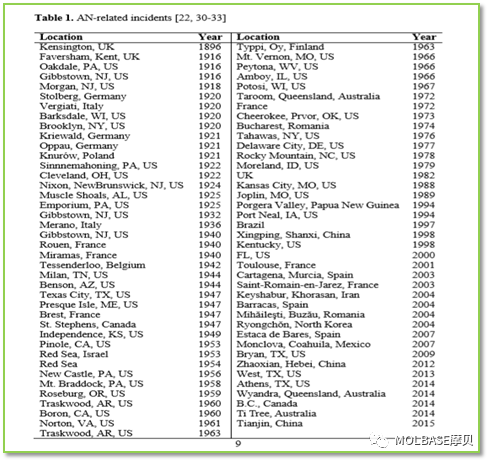
4、国内外硝酸铵爆炸事故统计
5、 硝酸铵的燃烧爆炸机理
学术界对硝酸铵的燃烧爆炸机理有不同的观点,普遍接受的第一种反应机理如下:
A 170°C时,融化的硝酸铵开始发生吸热可逆反应:
(2)NH4NO3 ⇌ HNO3 + NH3 ∆H=176 kJ·mol-1
B 在170°C和280°C之间,发生如下的不可逆放热反应
(3) NH4NO3 → N2O + 2H2O ∆H= -59 kJ·mol-1
(4) NH4NO3 → 1/2N2 + NO + 2H2O ∆H= -257 kJ·mol-1
(5) NH4NO3 → 3/4N2 + 1/2NO2 + 2H2O ∆H= -944 kJ·mol-1
C硝酸铵物料突然被加热,如在400°C,发生剧烈的爆炸分解反应:
(6)2NH4NO3 →2N2 + O2 + 4H2O ∆H= -1057 kJ·mol-1
(7)8NH4NO3 →5N2 + 4NO + 2NO2 + 16H2O ∆H= -600 kJ·mol-1
第二种公认的反应机理如下,普遍公认的分解机理是离解,HNO3导致NH3的后续氧化反应;方程式(8)为硝酸的离解反应,生成NO2+,反应方程式(9)中列出了NH3的氧化物,并生成N2O和水
( 8) 2HNO3 ⇌ NO2+ + NO3– + H2O
( 9) NH3 + NO2+ = products (N2O, H2O)
(10 ) 2HNO3 ⇌ 2NO2 + H2O + ½O2
为了更详细地解释反应方程式(8)和式(9),在存在水的情况下用“酸”表示NH4+、H3O+或HNO3,以下分解机理方程式(11)~方程式(13)做了说明,其中考虑反应方程式(12)由于反应速度慢,认为是控制步骤;
(11 ) HNO3 + acid ⇌ H2ONO2+ → NO2+ + H2O
(12 ) NO2+ + NH3 → [NH3NO2+] *
(13 ) [NH3NO2+] → NO2 + H3O+ → NO2 + H2O
反应方程式(12)也可以用基本反应来描述,在342-387°C的温度范围内,其中NO2+随后氧化成NH3,如反应方程式(14)~式(19)所列。反应方程式(20)是整体根据这个理论得出的化学计量方程式
(14 ) NH3 + NO2 → NH2 + HNO2
(15 ) NH2 + NO2 → NH + HNO2
(16 ) NH + NO2 → HNO + NO
(17 ) NH2 + NO → N2 + H2O
(18 ) 2HNO → N2O + H2O
(19 ) 2HNO2 → NO2 + H2O + NO
(20 ) 4NH3 + 5NO2 → N2O + 2N2 + 6H2O + 3NO
第三种假定方法,与前面提到的机制稍有不同,另一种方法,假设生成硝铵中间体,硝酸铵的分解,如反应方程式(21)~(25)所列
( 21) NH4+ + NO3– = NH3 + HONO2
(22 ) HONO2 → HO + NO2
(23 ) HO + NH3 → HOH + NH2
(24 ) NH2 + NO2 → NH2NO2
(25 ) NH2NO2 → N2O + H2O
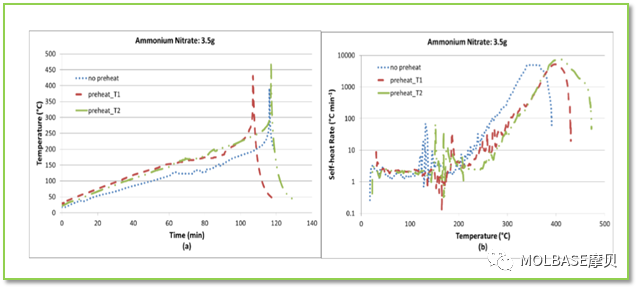
6、硝酸铵的热稳定实验发现
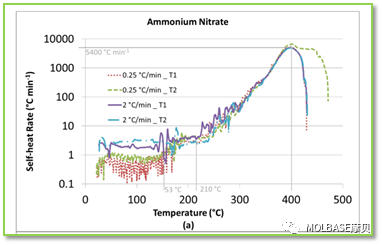
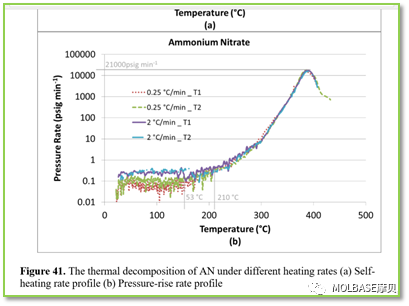
图41自加热速率与温度的关系,温度在200°C左右加热速率平缓增加,超过200°C直线上升。
图41自加热速率与压力的关系,温度在200°C左右加热速率平缓增加,超过200°C压力速率直线上升。实验结果表明当加热速率较快时,自加热速率和压力上升速度加快,反应更加剧烈。
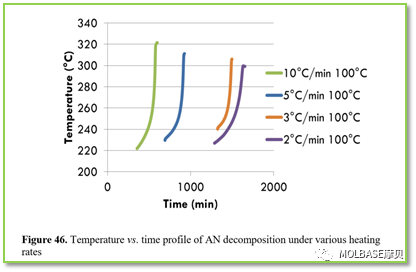
图46不同加热速率下的硝酸铵分解(温度和时间的关系)
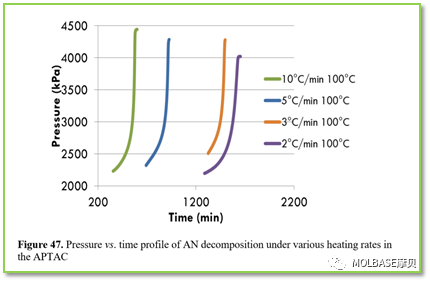
图47不同加热速率下的硝酸铵分解(压力和时间的关系)
图上,预加热的硝酸铵需要分解时间更短,达成同等温度需要时间更短;原因是当硝酸铵突然被加热时,加热过程被看作是连续的,并且绝热条件下等待和搜索的时间大大缩短,增加了自我加速硝酸铵的反应,分解发生得更快,因此如果突然升温,更容易发生分解。
7、氮氧化物的特点
氮氧化物指的是只由氮、氧两种元素组成的化合物。常见的氮氧化物有一氧化氮(NO,无色)、二氧化氮(NO2,红棕色)、一氧化二氮(N2O)、五氧化二氮(N2O5)等,其中除五氧化二氮常态下呈固体外,其他氮氧化物常态下都呈气态。作为空气污染物的氮氧化物(NOx)常指NO和NO2。除二氧化氮以外,其他氮氧化物均极不稳定,遇光、湿或热变成二氧化氮及一氧化氮,一氧化氮又变为二氧化氮。因此,职业环境中接触的是几种气体混合物常称为硝烟(气),主要为一氧化氮和二氧化氮,并以二氧化氮为主。氮氧化物都具有不同程度的毒性。
另外还有一氧化氮二聚体(N₂O₂)、叠氮化亚硝酰(N₄O)、三氧化氮(NO₃),但主要是NO和NO2,它们是常见的大气污染物。另外三硝基胺(N(NO2)3)也是仅由氮、氧元素组成的化合物,但不是严格意义上的氧化物。
五氧化二氮
除五氧化二氮为固体外, 其余均为气体。分子式NOx。其中四氧化二氮是二氧化氮二聚体,常与二氧化氮混合存在构成一种平衡态混合物。一氧化氮和二氧化氮的混合物,又称硝气(硝烟)。相对密度:一氧化氮接近空气,一氧化二氮、二氧化氮比空气略重。熔点: 五氧化二氮为30℃,其余均为零下。均微溶于水, 水溶液呈不同程度酸性。氮氧化物系非可燃性物质,但均能助燃,如一氧化二氮(N2O)、二氧化氮和五氧化二氮遇高温或可燃性物质能引起爆炸。
一氧化氮为氮氧化合物,化学式NO, 相对分子质量30.01,氮的化合价为+2。是一种无色无味气体难溶于水的有毒气体。由于一氧化氮带有自由基,这使它的化学性质非常活泼。当它与氧气反应后,可形成具有腐蚀性的气体——二氧化氮(NO2),二氧化氮可与水反应生成硝酸。方程式为:3NO2+H2O==2HNO3+NO。危险特性:具有强氧化性。与易燃物、有机物接触易着火燃烧。遇到氢气爆炸性化合。接触空气会散发出棕色有酸性氧化性的棕黄色雾。
一氧化二氮(nitrous oxide),化学式N2O。又称笑气,无色有甜味气体,是一种氧化剂,在一定条件下能支持燃烧(同氧气,因为笑气在高温下能分解成氮气和氧气),但在室温下稳定,有轻微麻醉作用,并能致人发笑。其麻醉作用于1799年由英国化学家汉弗莱·戴维发现。有关理论认为N2O与CO2分子具有相似的结构(包括电子式),则其空间构型是直线型,N2O为极性分子。现在主要用于表演,也可以用来做赛车加速器中的助燃剂。
二氧化氮是指高温下棕红色有毒气体。在常温下(0~21.5℃)二氧化氮与四氧化二氮混合而共存。有毒、有刺激性。溶于浓硝酸中而生成发烟硝酸。能叠合成四氧化二氮。与水作用生成硝酸和一氧化氮。与碱作用生成硝酸盐。能与许多有机化合物起激烈反应。二氧化氮在臭氧的形成过程中起着重要作用。人为产生的二氧化氮主要来自高温燃烧过程的释放,比如机动车尾气、锅炉废气的排放等。二氧化氮还是酸雨的成因之一,所带来的环境效应多种多样,包括:对湿地和陆生植物物种之间竞争与组成变化的影响,大气能见度的降低,地表水的酸化、富营养化(由于水中富含氮、磷等营养物藻类大量繁殖而导致缺氧)以及增加水体中有害于鱼类和其它水生生物的毒素含量。
8、硝酸铵的存储要求
1)储存建筑物高度不得超过一层,并必须有足够的通风,在发生火灾时应能够自动通风或能够充分通风
2)仓库在发生火灾时能自动通风或足够通风,
3)由于腐蚀性和硝酸铵的反应特性,避免污染,建筑物和构筑物应干燥,屋顶、墙壁和地板不渗水
4)建筑材料、容器满足分隔距离要求
5)针对氧化剂,如果可以设计成避光和避热的半地下层储藏间最好
6)考虑到水对硝酸铵的影响,日常储存区域灭火介质配备为黄沙
9、结论
农业用的化肥硝酸铵本身不是炸药,是5.1类强氧化剂或9类危险货物,爆炸主要原因是硝基NO3本身就是很不稳定的,在高温碰撞下很容易受热分裂,产生不稳定的氮氧化物,最后氮氧化物分裂产生稳定态的氮气和氧气,而氧气本身就是帮助燃烧,在大量释放氧气的情况下,加速燃烧。所以我们经历的各类硝基物爆炸,都是跟不稳定的硝基有关,面对此类化学物质的储存管控,做到如下的措施:
1)通风、防潮、防热
2)控制堆垛数量,严格执行禁忌混配原则
3)避免各类点火源(切割打磨等明火、静电火花、动火作业、防爆工具和防爆电器)
4)控制无关人员进出
5)控制储存总量,确保先进先出,确保最长存储周期小于理论计算的安全周
6)严格按照操作规程上下货物,严禁野蛮堆垛和装卸
7)做好破损包件的收集管理、严禁仓库内取样作业
8)按照甲类仓库设计规范配备必要的消防设施,并测试检查消防设施随时在可用状态
9)培训员工日常的操作能力和应急处置能力,定期开展应急演练
10)坚持日常巡检制度,确保有问题立即整改,不留隐患
- 上一篇:中考道德与法治总复习,19个必考知识点总结
- 下一篇:没有了


 微信收款码
微信收款码 支付宝收款码
支付宝收款码